- 作者: Kilby-Biot
- 来源:
- 日期 : 2025-11-28
最新发表于《Nature Reviews Drug Discovery》的综述文章 Published online: 12 November 2025,系统阐述了人类类器官在药物发现领域的应用价值、核心方法、实际应用、现存挑战及监管前景,为该技术在药物研发中的规模化应用提供了全面参考。
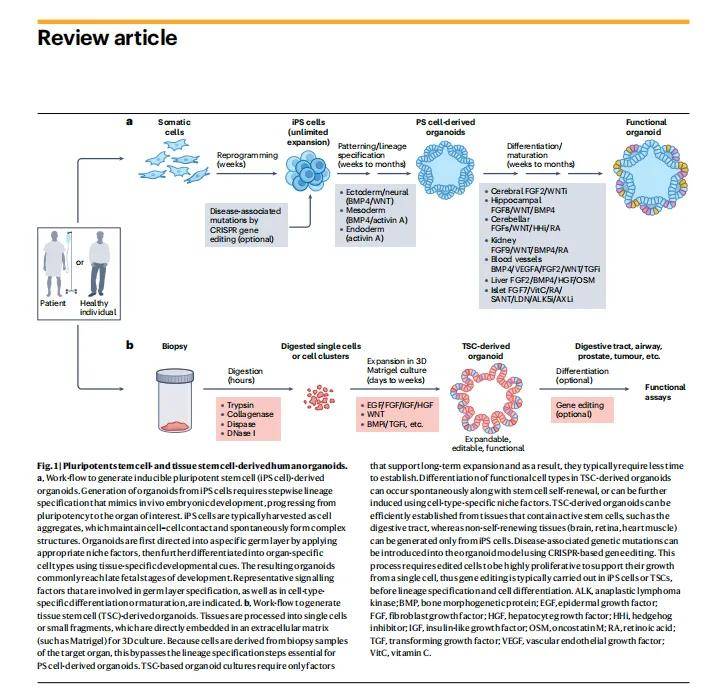
一、类器官技术核心概述
定义与本质
类器官是源自干细胞(多能干细胞或组织干细胞)的 3D 结构,能重现对应组织的关键结构和功能特征,比传统 2D 细胞系更贴近人体生理,且克服了动物模型的物种差异和伦理问题。
主要生成方法
- 多能干细胞(PS 细胞)衍生法:需模拟胚胎发育的分步谱系特化,从 iPS 细胞或 ES 细胞出发,经数周至数月培养,可生成脑、视网膜、肝等多种器官的类器官。
- 组织干细胞(TSC)衍生法:直接从活检样本或原代组织获取干细胞,无需谱系特化步骤,仅需支持性生长因子,数天至数周即可建立,适用于肠道、气道等含活跃干细胞的组织。
- 基因编辑整合:可通过 CRISPR 技术向类器官引入疾病相关突变,或修正患者来源类器官的缺陷基因,用于机制研究和药物测试。

与传统模型的对比优势
二、类器官在药物发现中的核心应用
2.1疾病建模
类器官已成功应用于多种疾病建模,为药物研发提供精准病理模型:
- 遗传性疾病:如囊性纤维化(CF),患者来源类器官可通过肿胀实验评估 CFTR 调节剂疗效,且与临床结果高度相关;还有原发性纤毛运动障碍、α1 - 抗胰蛋白酶缺乏症、多囊肾病等。
- 代谢性疾病:如代谢功能障碍相关脂肪性肝炎(MASH),类器官可重现脂质积累、炎症等核心表型,用于筛选降脂和抗炎药物;还包括家族性高胆固醇血症、线粒体 DNA 耗竭综合征等。
- 慢性炎症疾病:如炎症性肠病(IBD),通过类器官与免疫细胞共培养,可研究 T 细胞介导的上皮损伤机制;还有乳糜泻、慢性阻塞性肺疾病(COPD)等。
- 感染性疾病:可支持隐孢子虫、诺如病毒、寨卡病毒(ZIKV)、SARS-CoV-2 等病原体的完整生命周期,用于研究感染机制和筛选抗病毒药物。
- 癌症:患者来源肿瘤类器官(PDTOs)能保留原发肿瘤的组织学、遗传学特征,可用于药物敏感性测试、耐药机制研究,已建立胃癌、结直肠癌、胰腺癌等多种癌症的类器官生物库。
2.2 药物安全性评估:类器官可模拟多器官毒性反应,弥补传统毒性测试的不足:
- 肝脏毒性:能准确预测药物诱导的肝损伤(DILI),如曲格列酮、对乙酰氨基酚等已知肝毒性药物的评估,且对代谢介导的毒性更敏感。
- 肾脏毒性:可重现顺铂、庆大霉素等药物诱导的急性肾损伤,通过 KIM1 等标志物量化毒性程度。
- 胃肠道毒性:基于回肠类器官的检测方法预测药物诱导腹泻的准确率达 90%,还能研究多柔比星等药物的肠道损伤机制。
- 中枢神经系统毒性:可揭示长春新碱、紫杉醇等药物对脑发育的影响,以及抗抑郁药的剂量依赖性神经损伤。
- 心脏毒性:能模拟多柔比星诱导的心肌细胞凋亡、纤维化和线粒体功能障碍,且比 2D 模型更易检测 ATP 消耗和心跳异常。
2.3 药物吸收与代谢研究
肝脏类器官:表达 I 相(如 CYP3A4)和 II 相药物代谢酶及转运蛋白,可用于研究药物生物转化和胆汁排泄。
- 肠道类器官:通过 2Dtranswell 系统实现双向转运研究,能区分高 / 低通透性化合物,且可诱导 CYP 酶活性用于代谢研究。
- 肾脏类器官:部分模型已实现有机阳离子 / 阴离子转运体的功能性表达,为药物肾排泄评估提供工具。
2.4 个性化医疗应用
患者来源类器官(PDOs)可反映个体基因背景差异,实现 “精准药敏测试”。例如 CF 患者的肠道类器官能预测其对 CFTR 调节剂的应答,肿瘤类器官可指导化疗、靶向治疗甚至 CAR-T 疗法的个性化选择。
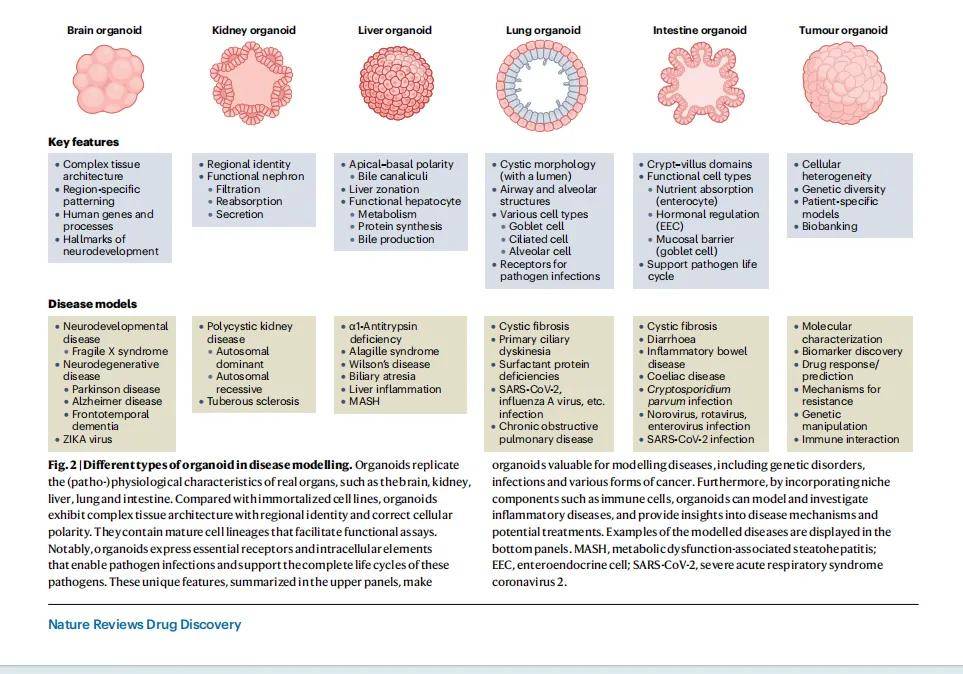
三、技术优化与进阶平台
3.1 现存挑战的解决方案
- 复杂性提升:通过共培养整合血管内皮细胞、免疫细胞、神经元等成分,构建 “类器官芯片” 或 “组装体”,模拟组织微环境的多细胞相互作用。
- 培养体系改良:开发无基质胶培养系统(如 Yersinia invasin 涂层 transwell)、微流控技术,改善营养输送和药物接触的均一性。
- 标准化与自动化:借助机器人液体处理、微孔阵列、生物打印等技术,实现类器官的批量生成和高通量筛选,提升实验可重复性。
3.2 进阶平台类型
- 类器官芯片:整合微流控技术,模拟体内流体剪切力和多器官间的系统通讯,用于多器官毒性和药物代谢研究。
- 免疫类器官:将自体组织驻留 T 细胞、巨噬细胞等整合进上皮类器官,用于研究免疫疗法的疗效和脱靶毒性。
- 多器官联合平台:如肝 - 心、肠 - 肝 - 肾等多器官类器官联用系统,模拟药物在体内的全身代谢和跨器官毒性。

四、监管现状与挑战
4.1 监管进展
- 政策支持:美国 FDA 通过《FDA 现代化法案 2.0》和 3.0,明确非动物模型在药物研发中的合法地位,计划逐步淘汰单克隆抗体等药物的动物测试。
- 认可路径:FDA 推出 “替代方法计划”,OECD 提供《良好体外方法规范》等指南,为类器官等新方法的监管资格认定提供框架。
- 行业协作:跨行业联盟与监管机构合作,制定类器官的表征、验证标准,推动其作为 “新方法学(NAMs)” 纳入监管申报。
4.2 核心监管挑战
- 模型资格认定:需针对特定应用场景(如某类药物的肝毒性测试)证明类器官的可靠性和相关性。
- 可重复性与标准化:不同实验室的培养方案、细胞来源差异可能导致结果不一致,需建立统一操作规范。
- 成本与技术门槛:类器官培养耗时且依赖专业设备,中小企业推广难度较大,需简化流程并降低成本。

五、结论与未来展望
类器官技术为药物发现提供了 “人体相关、高通量、可个性化” 的创新平台,在疾病建模、安全性评估和个性化医疗中展现出不可替代的价值。
未来需重点突破三大方向:一是提升模型复杂性(如血管化、免疫整合)和成熟度,二是建立标准化的培养、表征和数据分析流程,三是推动监管体系完善,实现类器官在药物研发全流程的规模化应用。随着技术迭代,类器官有望成为连接基础研究与临床转化的核心工具,推动药物研发向更精准、高效、伦理的方向发展。

附:Kirkstall Quasi Vivo 串联多器官芯片共培养系统的应用
Kirkstall Quasi Vivo 串联多器官芯片共培养系统作为融合微流控技术与类器官串联芯片培养的创新平台,凭借 “近生理微环境模拟”+“多器官动态互联”+“高兼容性与可操作性” 等核心优势,在疾病建模、药物研发、再生医学等领域展现出显著应用价值。
一、疾病机制研究:从 “单器官病理” 到 “多器官协同致病” 的深度解析
当前类器官研究多聚焦于单一器官的病理模拟,而 Kirkstall Quasi Vivo 系统的 “多器官串联” 特性,可重构体内器官间的物质交换与信号通讯,为复杂疾病(尤其是涉及多器官受累的慢性疾病)的机制研究提供全新视角。
(一)代谢性疾病的跨器官关联研究
(二)神经退行性疾病的 “外周 - 中枢” 交互机制探索
(三)肿瘤转移的多器官定植模型构建
二、药物研发:从 “单一器官毒性” 到 “全身代谢 - 毒性” 的精准预测
传统药物研发中,基于 2D 细胞或动物模型的安全性评估常因 “种属差异”“缺乏多器官代谢交互” 导致临床转化失败(如肝毒性药物在动物模型中未显现风险)。Kirkstall Quasi Vivo 系统可模拟药物在人体内的吸收、分布、代谢、排泄(ADME)全过程,结合多器官类器官的功能特性,实现对药物 “全身代谢 - 毒性” 的精准预测。
(一)药物代谢与毒性的跨器官联动评估
(二)个性化药物敏感性测试的临床转化
三、再生医学:从 “类器官培育” 到 “功能性组织移植” 的技术突破
类器官的临床应用瓶颈之一是 “体外培养的类器官难以达到体内组织的成熟度与功能完整性”,而 Kirkstall Quasi Vivo 系统通过模拟体内生理微环境(如流体剪切力、细胞间信号通讯),可显著提升类器官的成熟度,同时为 “类器官移植前的功能评估” 提供平台,推动再生医学从实验室走向临床。
(一)功能性肝类器官的体外成熟与移植前评估
(二)复杂组织工程产品的体外功能验证
四、免疫相关疾病研究:从 “静态细胞互作” 到 “动态免疫应答” 的全景模拟
免疫相关疾病(如 IBD、肿瘤免疫、感染性疾病)的核心是 “免疫细胞与靶器官细胞的动态互作”,传统静态共培养难以模拟体内免疫细胞的迁移、活化及信号传递过程。Kirkstall Quasi Vivo 系统可通过流体循环模拟免疫细胞的归巢过程,结合多器官串联实现 “免疫应答 - 靶器官损伤 - 全身炎症” 的全景模拟。
(一)炎症性肠病(IBD)的动态免疫损伤模型
(二)感染性疾病的 “免疫防御 - 器官损伤” 机制研究
Kirkstall Quasi Vivo 串联多器官芯片共培养系统的应用,本质是 “从模拟体内生理环境到解析复杂生命过程,从辅助研究工具到推动临床转化” 的跨越。未来,随着技术的进一步优化(如更高通量的模块设计、更精准的微环境调控)、与其他技术(如单细胞测序、AI 数据分析)的融合,以及监管体系的逐步完善,该系统有望在疾病机制研究、药物研发、再生医学等领域实现更大突破,成为连接基础研究与临床应用的核心平台,最终推动生命科学研究进入 “精准化、人性化、无动物实验” 的新时代。


友 情 通 知:
北京基尔比生物科技有限公司& Kirkstall Quasi Vivo 串联多器官芯片&Kilby 微超重力模拟系统将参展2025年11月29日举行的北京细胞生物学会2025学术年会,敬请关注!



